Sommario Contenuti
In fisica con l’espressione energia di ionizzazione si indica solitamente l’energia necessaria impiegata per rimuovere un elettrone da un atomo o da uno ione gassoso.
Per capire meglio cosa intendiamo, puoi pensare all’energia di ionizzazione (Ei) come ad una misurazione della difficoltà di rimuovere l’elettrone, o ancora più semplicemente, alla forza con un elettrone è legato agli altri.
Maggiore è l’energia di ionizzazione, più difficile sarà la rimozione dell’elettrone. Pertanto, possiamo affermare che l’energia di ionizzazione sia un indicatore della reattività.
L’energia di ionizzazione è importante perché può essere utilizzata per aiutare a prevedere la forza dei legami chimici. La sua unità viene riportata in kilojoule per mole (kJ/mole) o elettronvolt (eV).
Energia di ionizzazione: come funziona?
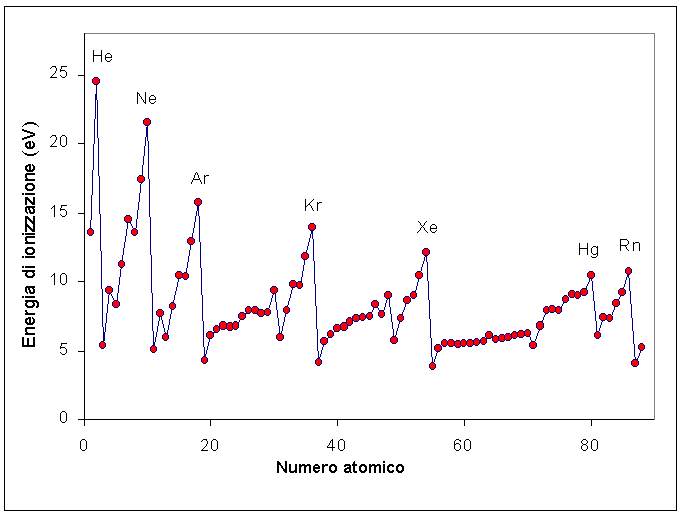
L’energia di ionizzazione, insieme al raggio atomico e ionico, all’elettronegatività, all’affinità elettronica e alla metallicità, segue una precisa tendenza sulla tavola periodica degli elementi:
- L’energia di ionizzazione generalmente aumenta passando da sinistra verso destra attraverso il periodo di un elemento (riga). Questo perché il raggio atomico, muovendosi attraverso il periodo, di solito diminuisce, pertanto c’è una maggiore attrazione effettiva tra gli elettroni caricati negativamente e il nucleo con carica positiva. La ionizzazione è al suo valore minimo per il metallo alcalino sul lato sinistro della tavola periodica e al suo valore massimo per il gas nobile che si trova sull’estremità destra. Il gas nobile ha un guscio di valenza pieno, quindi i suoi elettroni sono più resistenti alla rimozione.
- La ionizzazione diminuisce se ci si sposta dall’alto verso il basso in un gruppo di elementi (colonna). Questo perché il numero quantico principale dell’elettrone più esterno aumenta aumenta se ci si muove verso il basso della tavola periodica. Ci sono più protoni negli atomi che si spostano verso il basso in un gruppo (carica positiva maggiore), tuttavia l’effetto che si ottiene è soltanto quello di tirare i gusci elettronici, rendendoli più piccoli e schermando gli elettroni esterni dalla forza attrattiva del nucleo. Detto in parole povere, più gusci di elettroni si aggiungono e si spostano verso il basso del gruppo, più l’elettrone più esterno si allontanerà dal nucleo.
Energia di prima, seconda e terza ionizzazione: qual è la differenza?
L’energia necessaria per rimuovere l’elettrone di valenza più esterno da un atomo neutro è la prima energia di ionizzazione.
La seconda energia di ionizzazione è quella necessaria per rimuovere l’atomo successivo, e così via. La seconda energia di ionizzazione ha sempre un valore superiore rispetto alla prima energia di ionizzazione.
Per esempio, se prendiamo l’atomo di un metallo alcalino, la rimozione del primo elettrone è relativamente facile perché la sua perdita conferisce all’atomo un elettrone dal guscio più stabile.
Tuttavia la rimozione del secondo elettrone comporta anche la rimozione di un secondo gusto, che trovandosi più vicino al nucleo atomico, è anche più strettamente legato ad esso.
Fattori che possono influire sull’energia di ionizzazione
L’energia di ionizzazione può essere influenzata da due diversi fattori: in generale, quando ci sono più protoni nel nucleo, l’energia di ionizzazione aumenta, questo perché con più protoni che attraggono gli elettroni, è necessario impiegare una quantità di energia maggiore per superare la loro resistenza.
L’altro fattore è se il guscio esterno presenti più o meno elettroni: in un guscio completo, come ad esempio quello dell’elio, la rimozione degli elettroni risulta più difficile rispetto ad un guscio parzialmente pieno, in quanto proprio perché essendo completo, di conseguenza è anche più stabile.
I prodotti finali della ionizzazione: gli ioni
Uno ione è un atomo che ha una carica netta in quanto l’equilibrio tra il numero dei protoni e il numero degli elettroni è stato rotto.
Quando un elemento è ionizzato, il numero degli elettroni diminuisce, quindi rimane un eccesso di protoni e una carica positiva netta. Gli ioni caricati positivamente sono chiamati cationi.
Il sale da tavola (che in chimica è conosciuto con il termine di cloruro di sodio), per esempio, è un composto ionico che include la versione cationica dell’atomo di sodio, che ha subito la rimozione di un elettrone durante un processo che gli ha impartito l’energia di ionizzazione.
Sebbene non siano derivati dallo stesso tipo di ionizzazione, in quanto hanno un elettrone in più, gli ioni caricati negativamente sono chiamati anioni.
Come si calcola l’energia di ionizzazione

Il calcolo dell’energia di ionizzazione fa parte non solo delle basi della fisica moderna, ma spesso rappresenta anche il primo gradino per intuire il funzionamento di molte delle tecnologie da cui ormai dipendono la maggior parte delle nostre azioni quotidiane.
In questo calcolo, che è stato eseguito per la prima volta da Niels Bohr nel 1913, facendogli ottenere il premio Nobel, per prima cosa è necessario identificare il valore di “Z” per l’atomo (questo valore, nella tavola periodica, si trova al di sopra del simbolo dell’atomo).
Per esempio, se prendiamo in considerazione l’idrogeno, il suo valore “Z” sarà 1. A questo punto occorre decidere quanti elettroni racchiude l’atomo: di solito il valore equivale a quello di “Z” (esempio: per l’idrogeno, che ha valore 1, si può supporre che contenga un elettrone).
Fatto ciò, per calcolare l’energia di ionizzazione, a meno che l’atomo non abbia già perso alcuni elettroni, si dovrà fare la radice quadrata di Z e moltiplicare il risultato per 13,6. Il risultato ottenuto dovrà essere espresso in elettronvolt.


